Etude descriptive des complications de la dengue au cours de la flambée de 2016 à Ouagadougou au Burkina Faso
Kongnimissom Apoline Sondo, Arouna Gnamou, Ismael Diallo, Daye Ka, Jacques Zoungrana, Eric Arnaud Diendéré, Louise Fortes, Armel Poda, Djeneba Ly, Arsène Gafourou Ouédraogo, Lionel Wilfried Ouédraogo, Vincent Nikiema, Christiane Nikiema, Wendlassida Charles Joel Kagoné, Anta Zida, Guetawendé Sawadogo, Koussoubé Daouda, Issaka Yaméogo, Lassana Sangaré, Martial Ouédraogo, Georges Alfred Ki-Zerbo, Eboi Ehui, Cheikh Tidiane Ndour, Macaire Ouédraogo, Youssouf Joseph Drabo
Corresponding author: Kongnimissom Apoline Sondo, Service des Maladies Infectieuses et Tropicales, CHU Yalgado Ouédraogo, Ouagadougou, Burkina Faso, Unité de Formation et de Recherche en Sciences de la Santé, Université Joseph Ki-Zerbo, Ouagadougou, Burkina Faso 
Received: 16 Nov 2021 - Accepted: 11 Mar 2022 - Published: 31 Mar 2022
Domain: Infectious diseases epidemiology,Public health emergencies
Keywords: Dengue, descriptive, complications, 2016, Ouagadougou, Burkina Faso
©Kongnimissom Apoline Sondo et al. PAMJ-One Health (ISSN: 2707-2800). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Kongnimissom Apoline Sondo et al. Etude descriptive des complications de la dengue au cours de la flambée de 2016 à Ouagadougou au Burkina Faso. PAMJ-One Health. 2022;7:27. [doi: 10.11604/pamj-oh.2022.7.27.32454]
Available online at: https://www.one-health.panafrican-med-journal.com/content/article/7/27/full
Research 
Etude descriptive des complications de la dengue au cours de la flambée de 2016 à Ouagadougou au Burkina Faso
Etude descriptive des complications de la dengue au cours de la flambée de 2016 à Ouagadougou au Burkina Faso
Descriptive study of complications of dengue during the 2016 outbreak in Ouagadougou, Burkina Faso
![]() Kongnimissom Apoline Sondo1,2,&,
Kongnimissom Apoline Sondo1,2,&, ![]() Arouna Gnamou1, Ismael Diallo1,2, Daye Ka3,
Arouna Gnamou1, Ismael Diallo1,2, Daye Ka3, ![]() Jacques Zoungrana4, Eric Arnaud Diendéré1,2, Louise Fortes3, Armel Poda4, Djeneba Ly1, Arsène Gafourou Ouédraogo1, Lionel Wilfried Ouédraogo5, Vincent Nikiema6, Christiane Nikiema7,
Jacques Zoungrana4, Eric Arnaud Diendéré1,2, Louise Fortes3, Armel Poda4, Djeneba Ly1, Arsène Gafourou Ouédraogo1, Lionel Wilfried Ouédraogo5, Vincent Nikiema6, Christiane Nikiema7, ![]() Wendlassida Charles Joel Kagoné1, Anta Zida5,
Wendlassida Charles Joel Kagoné1, Anta Zida5, ![]() Guetawendé Sawadogo5, Koussoubé Daouda5, Issaka Yaméogo5,
Guetawendé Sawadogo5, Koussoubé Daouda5, Issaka Yaméogo5, ![]() Lassana Sangaré2, Martial Ouédraogo2, Georges Alfred Ki-Zerbo8,
Lassana Sangaré2, Martial Ouédraogo2, Georges Alfred Ki-Zerbo8, ![]() Eboi Ehui9, Cheikh Tidiane Ndour3, Macaire Ouédraogo4, Youssouf Joseph Drabo2
Eboi Ehui9, Cheikh Tidiane Ndour3, Macaire Ouédraogo4, Youssouf Joseph Drabo2
&Auteur correspondant
Introduction: la dengue sévère constitue la cause la plus fréquente d´hospitalisation et de décès parmi les enfants et les adultes en Asie. Les formes sévères étaient peu fréquentes en Afrique, mais elles sont de plus en plus notifiées. Afin de mieux comprendre l´épidémiologie des formes sévères de dengue observées au cours de cette flambée, nous avons mené cette étude descriptive dans la ville de Ouagadougou.
Méthodes: il s´agissait d´une étude transversale rétrospective à visée descriptive de 12 mois portant sur des patients présentant une forme sévère de la dengue, au niveau de 15 structures de santé. Le diagnostic de la dengue était fait par les tests Rapides Duo Bioline, puis quelques échantillons avaient permis d´identifier le stéréotype 2 du virus responsable de l´épidémie par l´institut Pasteur de Dakar.
Résultats: les patients de sexe masculin représentaient 57,5% de la population d´étude, l´âge moyen des patients était de 38 ans. La fréquence des formes sévères était de 33,8%. Les principales complications étaient l´insuffisance rénale aigüe, les complications neurologiques et la dengue hémorragique respectivement dans 20,2%, 19,6% et 17,3%. Le paludisme était associé dans 24,6% des cas. La létalité était de 7,2% parmi les formes sévères.
Conclusion: les complications de la dengue ne sont pas rares en Afrique et il faudrait rechercher les facteurs associés à cette sévérité, pour une meilleure prise en charge des cas de dengue.
Introduction: severe dengue fever is the most common cause of hospitalization and death among children and adults in Asia. Severe forms are uncommon in Africa, but they are increasingly reported. The purpose of this descriptive study, carried out in the city of Ouagadougou, is to better understand the epidemiology of severe forms of dengue observed during this outbreak. Methods: we conducted a 12-month retrospective, cross-sectional, descriptive study of patients with severe dengue in 15 health facilities. The diagnosis of dengue was based on BIOLINE Duo rapid test, and a few samples were found positive for serotype 2 dengue, responsible for the epidemic according to the Pasteur Institute in Dakar. Results: male patients accounted for 57.5% of the study population, with an average age of 38 years. The frequency of severe forms was 33.8%, the main complications were acute renal failure, neurological complications and haemorrhagic dengue, respectively in 20.2%, 19.6%, 17.3% of cases. Malaria was associated with it in 24.6% of cases. Lethality accounted for 7.2% among severe forms. Conclusion: complications of dengue are not uncommon in Africa, and factors associated with dengue severity should be investigated for a better management of dengue cases.
Key words: Dengue, descriptive, complications, 2016, Ouagadougou, Burkina Faso
La dengue, une arbovirose répandue et première cause de fièvre hémorragique virale dans le monde, pose un réel problème de santé publique en zone intertropicale [1]. La fréquence de la maladie et ses conséquences socio-économiques sont fortement sous-estimées dans cette région, en raison de l´insuffisance ou de l´absence de mécanisme de surveillance dans la plupart des pays ou encore de l´accès insuffisant aux tests pour son diagnostic [1,2]. Les formes sévères de la dengue font toute la gravité de la maladie. Leur fréquence est variable selon les études, les sites géographiques et la classification utilisée. Selon l´OMS, environ 500 000 cas de dengue hémorragique (DH) et de dengue avec syndrome de choc (DSS) surviennent chaque année, surtout chez les enfants et engendrent près de 20 000 décès [1]. La dengue sévère constitue la cause la plus fréquente d´hospitalisation et de décès parmi les enfants et les adultes en Asie [1]. Cependant elle semblait, jusqu´à récemment peu fréquente en Afrique [3]. En effet, la dengue hémorragique autrefois rencontrée en Asie et en Amérique est de plus en plus rapporté dans quelques études en Afrique [4,5]. La théorie de la race noire comme facteur protecteur de la dengue semble remise en cause, car la dengue est présente en Afrique avec une existence de formes sévères notifiées [4-6]. A l´instar d´autres pays de la région, le Burkina Faso a rapporté des cas de dengue dans des études depuis ces cinq dernières années [7]. Le virus de la dengue y circule depuis de nombreuses années selon certains auteurs [7,8]. La récente épidémie de 2016 a été la première grande épidémie connue par le pays et a fait environ 2526 cas suspects dont 1561 cas probables et 20 décès selon les données du ministère de la santé [9]. Afin de mieux comprendre l´épidémiologie des formes sévères de dengue observées au cours de cette flambée, nous avons mené cette étude descriptive dans la ville de Ouagadougou.
Type d´étude, choix des structures investiguées
Il s´est agi d´une étude transversale descriptive à visée rétrospective, menée dans 15 structures sanitaires (dont 4 CHU) de la ville de Ouagadougou. Cette ville est la plus grande du Burkina Faso avec près de 2 millions d´habitants. L´étude incluait toutes les formations sanitaires publiques (les centres hospitaliers universitaires et hôpitaux de district). Pour les structures privées, le choix a été motivé par la disponibilité du test de diagnostic rapide de la dengue. Les données ont été recueillies après avoir reçu l´approbation du comité d´éthique ainsi que celle du directeur régional de la santé.
Critères d´inclusion des patients
L'infection suspectée de dengue a été définie comme la présence de fièvre et deux des signes suivants: myalgie, céphalée, arthralgie, éruption cutanée, douleur rétro-orbitaire, manifestation(s) hémorragique(s) ou leucopénie (nombre de globules blancs (WBC) <4 x109 L-1). Un cas probable/confirmé de dengue était un cas suspect chez qui on avait un TDR (Test de diagnostic rapide) dengue Duo revenu positif, c'est-à-dire la détection de l´antigène NS1 et/ou des anticorps IGM ou IgG. Le test utilisé était le kit SD BIOLINE Dengue Duo. Les sujets de l'étude comprenaient des patients hospitalisés admis avec un TDR de la dengue positif et qui était classés dans le groupe C selon la classification OMS 2009 de la dengue.
Collecte des données et des variables étudiées
Les patients suspects de dengue étaient orientés vers les structures qui disposaient de moyens diagnostiques de la dengue (TDR). Les prélèvements étaient effectués dans ces structures de santé pour la réalisation du TDR de tous les patients, indépendamment de la date de début des symptômes. La collecte des données a été effectuée rétrospectivement à partir d´une étude de dossiers médicaux d´hospitalisation et de données de laboratoire. Les données clinico-biologiques ont été recensés à partir de fiches de collecte standardisée. Ces fiches de collectes étaient numérotées et anonymes permettant de garder la confidentialité des données. Les caractéristiques démographiques et les présentations cliniques des patients étaient enregistrées le jour de l'admission tandis que les résultats de laboratoire ont été enregistrés pour chaque jour d'hospitalisation jusqu'à la sortie. Les patients dont les dossiers étaient incomplets ont été exclus de l´étude.
Analyse des données
L'analyse a été effectuée à l'aide de la version du logiciel Epi Info 7.0.9.7. Les résultats sont présentés sous formes de tableaux et figures. Les variables quantitatives ont été décrites en termes de moyenne et écart-type; tandis que les variables qualitatives ont été exprimées sous forme d´effectifs et de pourcentages.
Définitions opérationnelles
Cas de dengue primaire: il s´agissait de tous les patients pour lesquels les IgG étaient négatifs.
Dengue sévère: définie comme étant la présence d´un ou plusieurs des critères de sévérité établis par l´OMS dans sa classification de 2009. Nous avons considéré les définitions suivantes: 1) la fuite plasmatique: définie par l´hémoconcentration avec une augmentation de l´hématocrite de plus de 45%; 2) l´hémorragie sévère: définie comme une hémorragie diffuse et/ou abondante avec déglobulisation nécessitant une transfusion sanguine; 3) les complications organiques: définies par l´hyper-transaminasémie > 1000 pour les ALAT et/ou les ASAT, la présence de troubles de la conscience évaluée par le Score de Glasgow, la confusion/convulsion, la thrombopénie sévère inférieure à 20 000 éléments/mm3 et l´insuffisance rénale aigue avec une créatininémie >176,8 micromoles/l selon la classification RIFLE.
Nous avons recensé 1201 patients hospitalisés pour suspicion de dengue, le TDR dengue est revenu positif chez 529 patients soit 44,05%. Parmi eux 179 patients avaient présenté des complications, soit une fréquence de 33,8%. Dans 90% des cas les patients avaient l´antigène NS1 positif et 14% avaient une dengue secondaire. La co-infection avec le paludisme était de 24,6%.
Caractéristiques sociodémographiques
L´âge moyen des patients était de 38 ans±16,41 et des extrêmes de 9 et 78 ans. La tranche d´âge la plus représentée était celle comprise entre 15-45 ans dans 67,6% des cas. Les patients de moins de 15 ans représentaient 2,5% de l´échantillon. Le sex ratio était de 1,35. Les caractéristiques sociodémographiques sont résumées dans le Tableau 1.
Antécédents des patients
Les tares les plus fréquentes étaient l´hypertension artérielle et le diabète respectivement dans 15% et 11% des cas. Des cas d´antécédents de dengue antérieure étaient retrouvés dans 2,2% des cas. L´automédication était fréquente dans 39% des cas, le plus souvent par des antipaludiques (26,3%), des antalgiques (23%) et des produits traditionnels (4%, près du tiers (30%) des patients avaient réalisés une consultation dans un centre de santé et avaient eu des traitements prescrits par des agents de santé avant leur hospitalisation ou référence dans une autre structure de niveau supérieur. Les traitements administrés étaient des antalgiques (100%), des antipaludiques (92,6%) et des anti-inflammatoires (22,2%).
Les complications
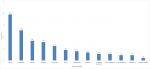
L´insuffisance rénale aigue était la complication la plus fréquente (n = 20,2%) dont 34,8% avaient bénéficié d´une hémodialyse. Les complications neurologiques représentaient 19,6%. La dengue hémorragique et l´atteinte hépatique étaient notées respectivement dans 17,3% et 13,8% des cas. Deux cas d´hémorragie cérébrale et un cas d´hémopéritoine étaient notés. Cinq patients ont présenté un syndrome d´insuffisance hépatocellulaire sévère avec encéphalopathie hépatique. Les complications cliniques et biologiques sont représentées sur le Tableau 2. Les types d´hémorragies sont représentés sur la Figure 1. Les échantillons de sang des patients envoyés à l´Institut Pasteur de Dakar a identifié le sérotype 2.
Evolution des patients
La durée moyenne d´hospitalisation était de 6 jours ± 5 jours avec des extrêmes de 1 et 52 jours. Quatorze (7,8%) patients étaient décédés parmi les formes sévères. Les patients décédés avaient des antécédents d´hypertension artérielle et de diabète dans 35,7% chacun. Les causes de décès étaient l´atteinte neurologique, l´insuffisance rénale aigüe et l´hémorragie avec état de choc respectivement dans 64,3%, 42,8% et 28,6%. La co-infection avec le paludisme était présente dans 28,57% des cas décédés.
Pour une première épidémie de dengue, la fréquence des complications reste très élevée dans notre population d´étude. Cette fréquence élevée pourrait s´expliquer par diverses raisons. D´abord par le sérotype 2 isolé au cours de l´épidémie qui est le plus représenté en Afrique, mais le plus virulent aussi à l´origine de formes sévères et d´une mortalité élevée; il est suivi par le sérotype 3 dans cette représentation [10,11]. Des auteurs ont montré la circulation des 3 sérotypes avec des cas de co-infections virales au Burkina Faso [8]. En effet des cas de réinfections probables par le virus de la dengue étaient présentes dans 14% des cas dans l´étude et quelques cas de dengue antérieur ont été également observés dans les antécédents de certains patients. Seulement, cette information n´avait pas été pas systématiquement demandée à tous les patients et en plus la dengue pourrait être passée inaperçue chez certains d´entre eux. La fréquence des formes sévères dans population d´étude, pourrait également s´expliquer par le type de classification utilisée. Dans la plupart des études publiées sur les formes sévères, les auteurs ont utilisé la classification de 1997 dont les complications se subdivisaient en deux groupes: la DH et la DSS [12,13].
Dans la classification de 2009 utilisée dans l´étude, elle prend en compte en plus de la DH et la DSS, les atteintes organiques telles que hépatiques, rénales, neurologiques, myocardiques etc, qui pourraient accroitre la mortalité et expliquer la fréquence des formes sévères [14,15]. A cette classification s´ajoute la présence de tares observées chez les patients (diabète, hypertension artérielle) qui aurait pu augmenter la fréquence des formes sévères selon plusieurs études en Asie [16-18]. D´autant plus que certains auteurs ont montré que la race noire était un facteur protecteur de la dengue sévère et expliquerait les faibles taux de formes sévères observées dans les séries africaines [19,20]. Malgré Tout, cette fréquence de formes sévères observée dans notre population d´étude serait sous-estimée. En effet il y a eu une sous notification des cas de dengue et plusieurs raisons expliqueraient cet état de fait.
L´accessibilité limitée des TDR dengue aux patients socialement moins précaires. En outre, au cours de l´épidémie de 2016, il y a eu une rupture de ces TDR. Les patients de l´étude étaient fréquemment des salariés du secteur privé ou public et avaient un niveau d´étude plus élevé, ce qui justifie leur accès au diagnostic. La sous notification pourrait s´expliquer aussi par la faible fréquence des cas de dengue sévère chez l´enfant par rapport à ce qui est rapporté dans la littérature, que les formes sévères de dengue se recrutaient surtout chez l´enfant avec un risque élevé de décès [21,22]. La forte similarité du paludisme avec la dengue pourrait expliquer cette sous notification aussi bien chez l´enfant que chez l´adulte. Cette maladie est encore peu connue des praticiens de santé dans la région Afrique et elle serait fortement sous-notifiée car la présentation clinique, ressemble fortement au paludisme ou à d'autres maladies tropicales fébriles [2,23]. Cette méconnaissance était observée dans notre population d´étude avec les prescriptions systématiques des antipaludiques, et ou des anti-inflammatoires par les agents de santé.
L´insuffisance rénale aigüe était la complication la plus fréquente dans 20,2% des cas. Des fréquences plus faibles d´atteinte rénale au cours de la dengue ont été rapportées en Asie respectivement dans 4% et 14%; l´atteinte rénale était significativement associée à la mortalité dans les deux études [24,25]. Cette théorie pourrait expliquer le taux élevé de décès avec une insuffisance rénale aigüe (IRA) dans notre population d´étude. Les atteintes neurologiques étaient aussi fréquentes dans 19,6% des cas, fait essentiellement d´un syndrome confusionnel, de coma (Glasgow <8) de convulsion et de paralysie. Les formes neurologiques sont très rarement décrites au cours de la dengue. En 2015, Diallo retrouvait 4,08% de cas d´encéphalopathie dans son étude à Ouagadougou dans une clinique privée [26] et en nouvelle Calédonie, une fréquence de 4,03% a été retrouvée [27]. Il a été montré que le virus de la dengue pourrait entrainer des troubles neurologiques et qu´environ 10% des patients présentent des signes neurologiques pendant ou après l´infection. Ces signes neurologiques accompagneraient les formes graves de dengue [28-30]. En effet dans notre étude les formes comateuses se recrutaient parmi ceux qui avaient un état de choc. Osnaya et al. dans leur étude ont présenté deux cas de complications neurologiques de la dengue chez des enfants qui sont décédés quelques jours après leur hospitalisation; des manifestations à type de confusion, d´encéphalite et d´œdème cérébral [28]. Dans notre population d´étude, deux cas d´hémorragie cérébrale et une séquelle à type de neuropathie périphérique ont été observés dans l´étude; certains auteurs ont observé des cas d´accidents vasculaires cérébraux hémorragiques et des séquelles neurologiques [30,31]. Parmi les patients décédés dans notre population d´étude plus de 60% présentaient des formes neurologiques. Les manifestions neurologiques sont le plus souvent graves à l´origine d´une forte létalité [28,31,32]. Il faudra alors les rechercher et assurer une prise en charge précoce de ces cas.
La fréquence des hémorragies sévères était faible dans notre population d´étude, comparativement aux autres auteurs où elle constitue la plus fréquente des complications et la principale cause d´hospitalisation et de décès [33]. Des hémorragies avec un syndrome de choc étaient fréquentes dans 7,2% des cas. Le choc hypovolémique est la plus redoutée des complications de la dengue, responsable d´une mortalité pouvant aller jusqu´à 10%, malgré les mesures de réanimation [34]. Une fréquence de la dengue hémorragique avec état de choc (28,57%) étaient retrouvée parmi les décès. Selon certains auteurs, le risque de décès au cours de la dengue avec saignement pourrait être favorisé par des comorbidités ou des désordres sous-jacents [35,36]. La drépanocytose à l´origine d´une anémie chronique, pourrait aggraver une hémorragie de moindre degré et faire progresser plus rapidement le patient vers une forme sévère. Des auteurs ont trouvé que la drépanocytose était un facteur associé aux formes sévères surtout celles hémorragiques [21,36]; or nous avons observé quelques cas (4%) de drépanocytose dans notre population d´étude. Le dépistage de la drépanocytose devrait être systématique chez le patient atteint de dengue dans le but d´assurer une prise en charge adaptée et préventive. Il est également décrit que l´apoptose des cellules endothéliales pourrait être en lien avec la fuite plasmatique [37], dont la fréquence était de 2,2% dans notre étude. Dans notre population d´étude nous avons observé des cas d´hémopéritoine, et d´hémorragie cérébrale rarement décrit dans la littérature.
L´élévation des transaminases au-delà de 1000 UI était fréquente dans 20,7%. Le virus de la dengue comme le virus amaril a une phase de réplication dans les hépatocytes, à l´origine des atteintes hépatiques et de l´apoptose cellulaire [38-40]. En effet des études rapportent une élévation des transaminases lors des dengues sévères, estimée entre 10 et 20 fois la normale [41,42]. Des cas d'insuffisance hépatique étaient retrouvés chez cinq patients dans notre étude. En Asie au cours des épidémies des cas d´insuffisance hépatiques ont été associés à la dengue hémorragique ou à la dengue avec syndrome de choc [40]. Djossou dans son étude a montré que l´élévation des transaminases semble être associée à plusieurs facteurs, entre autres la prise concomitante de paracétamol [42]. L´automédication par le paracétamol, les antipaludiques, les anti-inflammatoires ou encore les traitements traditionnels pourraient expliquer l´atteinte hépatique et la fréquence élevée de ses formes sévères dans notre étude. Nous n´avons pas pu doser les enzymes musculaires devant l´élévation des ASAT, mais dans la littérature il est démontré que plus de 4% des patients atteints de dengue développeraient des complications neuromusculaires telles que des myalgies des myosites et des rhadomyolyses [28,30]. Le parasite responsable du paludisme, tout aussi hépatotrope comme le virus responsable de la dengue pourrait aussi augmenter la fréquence de l´atteinte hépatique dans notre étude. En effet son association avec la dengue a été retrouvée dans 24,6% parmi les formes compliquées et dans 28,6% parmi les décès dans notre étude. Ces fréquences sont élevées et la question que l´on se pose, est que cette co-infection de la dengue avec le paludisme serait-elle associée aux formes sévères de la dengue et vice versa dans notre contexte tropical?
La thrombopénie était également fréquente chez 89% des patients dont 16% avec une thrombopénie sévère. Krishnamoorthy dans son étude a trouvé une mortalité significativement plus élevée chez les patients présentant une thrombopénie sévère (inférieure à 20000) [43]. Avec cette association démontrée, il serait important d´avoir des protocoles thérapeutiques avec des normes de transfusion des plaquettes. La létalité observée est élevée dans notre population d´étude or habituellement la dengue est bénigne. Des auteurs ont montré que certaines complications pourraient conduire à un état de choc ou à une défaillance multi-systémique qui pourrait s'aggraver en présence de comorbidités [36,40]. Les complications étaient fréquentes et diverses circonstances pourraient expliquer cette fréquence. Ces circonstances pourraient être le retard diagnostic lié à la confusion de la dengue avec d´autres maladies tropicales fébriles, la méconnaissance de la dengue par les agents de santé, l´automédication, etc.
Limites
Il s'agit d'une étude transversale et les données ont été recueillies à la fin des soins du patient. Le type d'étude utilisé pourrait affecter nos résultats. De même le biais de sélection de la population d´étude en rapport avec l´accessibilité limitée des TDR dengue aux patients socialement moins précaires et la rupture des TDR pendant l´épidémie de 2016 (plusieurs cas suspects de dengue n´ont pu ainsi être confirmés).
Les complications de la dengue sont fréquentes dans notre contexte et il faudra les rechercher systématiquement dès la confirmation. La recherche des facteurs associés à ces formes sévères permettrait d´améliorer la qualité de la prise en charge de la dengue au Burkina Faso.
Etat des connaissances sur le sujet
- La dengue est une maladie bénigne dont les formes sévères sont rares en Afrique;
- Les formes sévères surviennent surtout chez les patients ayants des affections chroniques telles que drépanocytose, HTA, diabète;
- La létalité est moins élevée en Afrique.
Contribution de notre étude à la connaissance
- Notre étude demontre la fréquence élevée des formes sévères de la dengue, le taux de létalité supérieur aux normes de l´OMS;
- Notre étude confirme que la coïnfection dengue-paludisme est élevée en zone tropicale et cette coinfections pouraient etre plus létales que chacune de ces infections seule.
Les auteurs ne déclarent aucun conflit d'intérêts.
KAS, EAD, AG, ID et LWO ont rédigé le protocole de recherche et dirigé l´étude. AG, WCJK, CN, VN ont collecté des données. AG, DL, AGO, GS, KD, AZ et IY ont assemblé, analysé les données. AG, KAS, JZ, AP, DK, LF, DK et ZT ont fourni la bibliographie. LS, MO, GAKZ, EE, CTN, MO et YJD ont validé l´article. Tous les auteurs ont lu et approuvé la version finale du manuscrit.
Nos remerciements vont aux patients, au directeur régional de la santé du centre, aux agents de santé des sites de l´étude et à tous ceux qui ont assuré la collecte des données.
Tableau 1: caractéristiques sociodémographiques des cas compliquées de dengue
Tableau 2: répartition des patients selon les complications cliniques et biologiques
Figure 1: proportion des types d´hémorragies observés dans notre population d´étude
- Bhatt S, Gething PW, Brady OJ, Messina JP, Farlow AW, Moyes CL et al. The global distribution and burden of dengue. Nature. 2013 Apr 25;496(7446):504-7. PubMed | Google Scholar
- Amarasinghe A, Kuritsk JN, Letson GW, Margolis HS. Dengue virus infection in Africa. Emerg Infect Dis. 2011 Aug;17(8):1349-54. PubMed | Google Scholar
- Jaenisch T, Tam DTH, Kieu NTT, Van Ngoc T, Nam NT, Van Kinh N et al. Clinical evaluation of dengue and identification of risk factors for severe disease: protocol for a multicentre study in 8 countries. BMC Infect Dis. 2016 Mar 11;16:120. PubMed | Google Scholar
- Jaenisch T, Junghanss T, Wills B, Brady OJ, Eckerle I, Farlow A et al. Dengue expansion in Africa-not recognized or not happening? Emerg Infect Dis. 2014 Oct;20(10):e140487. PubMed | Google Scholar
- Faye O, Ba Y, Faye O, Talla C, Diallo D, Chen R et al. Urban epidemic of dengue virus serotype 3 infection, Senegal, 2009. Emerg Infect Dis. 2014 Mar;20(3):456-9. PubMed | Google Scholar
- Aoussi EBF, Ehui E, Kassi NA, Kouakou G, Nouhou Y, Adjogoua EV et al. Seven native cases of dengue in Abidjan, Ivory Coast. Med Mal Infect. 2014 Sep;44(9):433-6. PubMed | Google Scholar
- Tarnagda Z, Congo M, Sagna T, Ouédraogo C, Nikiéma V, Cissé A et al. Outbreak of dengue fever in Ouagadougou, Burkina Faso, 2013. International Journal of Microbiology and Immunology Research. 2014;2(7):101-8. Google Scholar
- Ridde V, Agier I, Bonnet E, Carabali M, Dabiré KR, Fournet F et al. Presence of three dengue serotypes in Ouagadougou (Burkina Faso): research and public health implications. Infect Dis Poverty. 2016;5:23. PubMed | Google Scholar
- Service de surveillance épidémiologique. Flambée de cas de dengue au Burkina Faso: situation épidémiologique de la dengue: Rapport de situation N˚52. Ouagadougou: Ministère de la santé (Burkina Faso); 2016.
- Robert V, Lhuillier M, Meunier D, Sarthou JL, Monteny N, Digoutte JP et al. Yellow fever virus, dengue 2 and other arboviruses isolated from mosquitos, in Burkina Faso, from 1983 to 1986. Entomological and epidemiological considerations. Bull Soc Pathol Exot. 1993;86(2):90-100. PubMed | Google Scholar
- Tarnagda Z, Cissé A, Bicaba BW, Diagbouga S, Sagna T, Ilboudo AK et al. Dengue Fever in Burkina Faso, 2016. Emerg Infect Dis. 2018 Jan;24(1):170-172. PubMed | Google Scholar
- Guzman MG, Harris E. Dengue. Lancet. 2015 Jan 31;385(9966):453-65. PubMed
- Horstick O, Martinez E, Guzman MG, Martin JLS, Ranzinger SR. WHO dengue case classification 2009 and its usefulness in practice: an expert consensus in the Americas. Pathog Glob Health. 2015 Feb;109(1):19-25. PubMed | Google Scholar
- Amâncio FF, Heringer TP, de Oliveira C da CHB, Fassy LB, de Carvalho FB, Oliveira DP, et al. Clinical Profiles and Factors Associated with Death in Adults with Dengue Admitted to Intensive Care Units, Minas Gerais, Brazil. PLoS One. 2015;10:e0129046. PubMed | Google Scholar
- Deen JL, Harris E, Wills B, Balmaseda A, Hammond SN, Rocha C et al. The WHO dengue classification and case definitions: time for a reassessment. Lancet. 2006 Jul 8;368(9530):170-3. PubMed | Google Scholar
- Toledo J, George L, Martinez E, Lazaro A, Han WW, Coelho GE et al. Relevance of non-communicable comorbidities for the development of the severe forms of dengue: a systematic literature review. PLoS Negl Trop Dis. 2016;10:e0004284. PubMed | Google Scholar
- Htun NSN, Odermatt P, Eze IC, Boillat-Blanco N, D´Acremont V, Probst-Hensch N. Is diabetes a risk factor for a severe clinical presentation of dengue?--review and meta-analysis. PLoS Negl Trop Dis 2015;9:e0003741. PubMed | Google Scholar
- Figueiredo MAA, Rodrigues LC, Barreto ML, Lima JWO, Costa MCN, Morato V et al. Allergies and diabetes as risk factors for dengue hemorrhagic fever: results of a case control study. PLoS Negl Trop Dis 2010;4:e699. PubMed | Google Scholar
- Chacón-Duque JC, Adhikari K, Avendaño E, Campo O, Ramirez R, Rojas W et al. African genetic ancestry is associated with a protective effect on Dengue severity in colombian populations. Infect Genet Evol. 2014 Oct;27:89-95. PubMed | Google Scholar
- de la Sierra BC, Kourí G, Guzmán MG. Race: a risk factor for dengue hemorrhagic fever. Arch Virol. 2007;152(3):533-42. PubMed | Google Scholar
- Anders KL, Nguyet NM, Chau NVV, Hung NT, Thuy TT, Lien LB et al. Epidemiological factors associated with dengue shock syndrome and mortality in hospitalized dengue patients in Ho Chi Minh City, Vietnam. Am J Trop Med Hyg. 2011 Jan;84(1):127-34. PubMed | Google Scholar
- Tantawichien T. Dengue fever and dengue haemorrhagic fever in adolescents and adults. Paediatr Int Child Health. 2012 May;32 Suppl 1(s1):22-7. PubMed | Google Scholar
- Coulibaly Adelise O. Etat de connaissance des agents de santé sur la prise en charge de la dengue dans la ville de Ouagadougou. Ouagadougou, 2015.
- Kuo MC, Lu PL, Chang JM, Lin MY, Tsai JJ, Chen YH et al. Impact of renal failure on the outcome of dengue viral infection. Clin J Am Soc Nephrol. 2008 Sep;3(5):1350-6. PubMed | Google Scholar
- Mallhi TH, Khan AH, Sarriff A, Adnan AS, Khan YH, Jummaat F. Defining acute kidney injury in dengue viral infection by conventional and novel classification systems (AKIN and RIFLE): a comparative analysis. Postgrad Med J. 2016 Feb;92(1084):78-86. PubMed | Google Scholar
- Diallo I, Sondo KA, Tieno H, Tamelokpo EY, Zoungrana J, Sagna Y et al. About 98 cases of dengue hospitalized in a private clinic of Ouagadougou: epidemiology, diagnostic and evolution. Bull Soc Pathol Exot. 2017 Dec;110(5):291-296. PubMed | Google Scholar
- Lefevre RA. Analyse descriptive de la prise en charge des patients atteints de dengue en Nouvelle-Calédonie. 2010.
- Osnaya-Romero N, Perez-Guille MG, Andrade-García S, Gonzalez-Vargas E, Borgaro-Payro R, Villagomez-Martinez S et al. Neurological complications and death in children with dengue virus infection: report of two cases. J Venom Anim Toxins Incl Trop Dis. 2017;23:25. PubMed | Google Scholar
- Carod-Artal FJ, Wichmann O, Farrar J, Gascón J. Neurological complications of dengue virus infection. Lancet Neurol. 2013 Sep;12(9):906-919. PubMed | Google Scholar
- Garg RK, Malhotra HS, Jain A, Malhotra KP. Dengue-associated neuromuscular complications. Neurol India. Jul-Aug 2015;63(4):497-516. PubMed | Google Scholar
- Solomon T, Dung NM, Vaughn DW, Kneen R, Thao LT, Raengsakulrach B et al. Neurological manifestations of dengue infection. Lancet. 2000 Mar 25;355(9209):1053-9. PubMed | Google Scholar
- Palma-da Cunha-Matta A, Soares-Moreno SA, Cardoso-de Almeida A, Aquilera-de Freitas V, Carod-Artal FJ. Neurological complications arising from dengue virus infection. Rev Neurol. 2004 Aug 1-15;39(3):233-7. PubMed | Google Scholar
- Murray NEA, Quam MB, Wilder-Smith A. Epidemiology of dengue: past, present and future prospects. Clin Epidemiol. 2013 Aug 20;5:299-309. PubMed | Google Scholar
- Ranjit S, Kissoon N, Jayakumar I. Aggressive management of dengue shock syndrome may decrease mortality rate: a suggested protocol. Pediatr Crit Care Med. 2005 Jul;6(4):412-9. PubMed | Google Scholar
- Chang K, Huang CH, Lee IK, Lu PL, Lin CY, Chen TC et al. Differences in Mortality and Clinical Manifestations of Dengue Hemorrhagic Fever in Taiwan in Different Years: A Comparison for Cases in 2014 and 2015 Epidemics. Am J Trop Med Hyg. 2017 Aug;97(2):361-368. PubMed | Google Scholar
- Limonta D, González D, Capó V, Torres G, Pérez AB, Rosario D et al. Fatal severe dengue and cell death in sickle cell disease during the 2001-2002 Havana dengue epidemic. Int J Infect Dis. 2009 Mar;13(2):e77-8. PubMed | Google Scholar
- D L, V C, G T, Ab P, Mg G. Apoptosis in tissues from fatal dengue shock syndrome. Journal of Clinical Virology?: The Official Publication of the Pan American Society for Clinical Virology. 2007;40(1):50-54. Google Scholar
- Alvarez ME, Ramírez-Ronda CH. Dengue and hepatic failure. Am J Med. 1985 Nov;79(5):670-4. PubMed | Google Scholar
- Lum LC, Lam SK, George R, Devi S. Fulminant hepatitis in dengue infection. The Southeast Asian Journal of Tropical Medicine and Public Health. 1993 Sep;24(3):467-71. PubMed | Google Scholar
- Parkash O, Almas A, Jafri SMW, Hamid S, Akhtar J, Alishah H. Severity of acute hepatitis and its outcome in patients with dengue fever in a tertiary care hospital Karachi, Pakistan (South Asia). BMC Gastroenterol. 2010 May 7;10:43. PubMed | Google Scholar
- Masson E, Van-Mai Cao-Lormeau. Diagnostic biologique de la dengue. EM-Consulte. Accessed December 23, 2021.
- Djossou F, Vesin G, Walter G, Epelboin L, Mosnier E, Bidaud B et al. Incidence and predictive factors of transaminase elevation in patients consulting for dengue fever in Cayenne Hospital, French Guiana. Trans R Soc Trop Med Hyg. 2016 Feb;110(2):134-40. PubMed | Google Scholar
- Krishnamoorthy S, Bhatt AN, Mathew CT, Ittyachen AM. Hepatitis and thrombocytopenia: markers of dengue mortality. Trop Doct. 2017 Apr;47(2):136-141. PubMed | Google Scholar
Search
This article authors
On Pubmed
- Kongnimissom Apoline Sondo
- Arouna Gnamou
- Ismael Diallo
- Daye Ka
- Jacques Zoungrana
- Eric Arnaud Diendéré
- Louise Fortes
- Armel Poda
- Djeneba Ly
- Arsène Gafourou Ouédraogo
- Lionel Wilfried Ouédraogo
- Vincent Nikiema
- Christiane Nikiema
- Wendlassida Charles Joel Kagoné
- Anta Zida
- Guetawendé Sawadogo
- Koussoubé Daouda
- Issaka Yaméogo
- Lassana Sangaré
- Martial Ouédraogo
- Georges Alfred Ki-Zerbo
- Eboi Ehui
- Cheikh Tidiane Ndour
- Macaire Ouédraogo
- Youssouf Joseph Drabo
On Google Scholar
- Kongnimissom Apoline Sondo
- Arouna Gnamou
- Ismael Diallo
- Daye Ka
- Jacques Zoungrana
- Eric Arnaud Diendéré
- Louise Fortes
- Armel Poda
- Djeneba Ly
- Arsène Gafourou Ouédraogo
- Lionel Wilfried Ouédraogo
- Vincent Nikiema
- Christiane Nikiema
- Wendlassida Charles Joel Kagoné
- Anta Zida
- Guetawendé Sawadogo
- Koussoubé Daouda
- Issaka Yaméogo
- Lassana Sangaré
- Martial Ouédraogo
- Georges Alfred Ki-Zerbo
- Eboi Ehui
- Cheikh Tidiane Ndour
- Macaire Ouédraogo
- Youssouf Joseph Drabo