Maladies infectieuses émergentes : transmission et épidémiologie
Mick Ya Pongombo Shongo, Toni Kasole Lubala, Olivier Mukuku, André Kabamba Mutombo, Paulo Muntu Bunga, Albert Mwembo Tambwe, Michel Balaka Ekwalanga, Oscar Numbi Luboya, Stanis Okitotsho Wembonyama
Corresponding author: oliviermukuku@yahoo.fr 
Received: 02 Aug 2020 - Accepted: 09 Sep 2020 - Published: 28 Oct 2020
Domain: Hygiene and sanitation,Infectious disease,Tropical medicine
Keywords: Infections émergentes, définition, transmission, maladie à Coronavirus 2019
©Mick Ya Pongombo Shongo et al. PAMJ-One Health (ISSN: 2707-2800). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Mick Ya Pongombo Shongo et al. Maladies infectieuses émergentes : transmission et épidémiologie. PAMJ-One Health. 2020;3:11. [doi: 10.11604/pamj-oh.2020.3.11.25309]
Available online at: https://www.one-health.panafrican-med-journal.com/content/article/3/11/full
Maladies infectieuses émergentes : transmission et épidémiologie
Emerging infectious diseases: transmission and epidemiology
Mick Ya Pongombo Shongo1, Toni Kasole Lubala1, Olivier Mukuku2&, André Kabamba Mutombo3, Paulo Muntu Bunga4, Albert Mwembo Tambwe1, Michel Balaka Ekwalanga1, Oscar Numbi Luboya1,2
&Auteur correspondant
Les maladies infectieuses émergentes sont des problèmes mondiaux. Il s´agit soit des pathologies dont le nombre de cas augmente en un lieu donné soit des pathologies qui resurgissent dans un milieu où elles avaient déjà disparu. Elles peuvent être d´origine bactérienne, virale, toxiques, métabolique ou autres. Elles peuvent toucher aussi bien des populations animales, végétales, qu´humaines. La transmission se déroule en 3 étapes à savoir l´introduction du germe dans une espèce donnée, dissémination puis enfin sa pérennisation. Dans cet article, nous présentons essentiellement les maladies émergentes bactériennes dans la population humaine avec un clin d´œil à l´actuelle pandémie du COVID-19. Au XXIème siècle, la surveillance et le contrôle des maladies infectieuses émergentes devraient reposer en premier lieu sur une coopération internationale.
Emerging infectious diseases are a global problems. These include diseases whose incidence is increasing or pathologies that reappear in a specific environment where they had previously disappeared. They are diseases of bacterial, viral, toxic, metabolic or other origin. They can affect animals, humans, and plants. Transmission may occur through three stages, namely the introduction of the germ into a given species, its dissemination and finally its perpetuation. This study reports emerging bacterial diseases in the human population with a nod to current COVID-19 pandemic. In the twenty-first century, monitoring and control of emerging infectious diseases should be implemented with international cooperation.
Key words: Emerging infections, definition, transmission, coronavirus disease 2019
Les maladies infectieuses émergentes à travers l´histoire ont inclus certains des fléaux les plus redoutés. De nouvelles infections continuent d´émerger aujourd´hui, et des anciennes sévissent encore. Ces maladies infectieuses émergentes sont des problèmes mondiaux. Comme le montrent les épidémies de Syndrome respiratoire aigüe sévère (SARS) et plus récemment la maladie à Coronavirus 2019 (COVID-19) [1]. Dans des circonstances appropriées, une nouvelle infection apparue pour la première fois partout dans le monde pourrait traverser des continents entiers en quelques jours ou semaines. Les maladies infectieuses émergent à un rythme sans précédent avec des impacts importants sur les économies mondiales et la santé publique [2]. Ce concept, émergence, apparait dès les années 1930 [3]. Mais il est clairement utilisé dans la dernière décennie du siècle dernier [4,5]. Ce terme sera introduit dans le thesaurus sur PubMed en 2001 [6]. Emergence renvoie au mot « émerger », provenant du latin emergere, de mergere = plonger. Pour « émerger », on trouve : se dégager, sortir d´un milieu après y avoir été plongé, apparaître au-dessus du niveau de l´eau, sortir de l´ombre, Apparaître plus clairement [7].
Définition: une maladie émergente est une maladie dont l´incidence réelle augmente de manière significative dans une population donnée, d´une région donnée et durant une période donnée, par rapport à la situation épidémiologique habituelle de cette maladie. Cette définition s´applique aussi bien aux maladies de l´homme qu´à celles des animaux ou des végétaux. Même si les maladies émergentes sont principalement de nature infectieuse, il peut s´agir d´autres types de maladies, toxiques, métaboliques ou autres [7]. En termes épidémiologiques il s´agit d´une maladie qui apparaît ou dont l´incidence augmente en un lieu donné [8]. Cependant, on parlera de réémergence lorsqu´il s´agira d´une maladie connue qui avait diminué ou disparu et qui réapparaît ou augmente [9].
Modes de transmission et émergence: pour contrôler la diffusion d´une maladie infectieuse dans une population, il faut connaître de manière précise les modalités de transmission de l´agent en cause, l´existence éventuelle de réservoirs naturels et les caractéristiques des vecteurs en cause. Il existe 2 types de transmission [10]. La transmission directe a lieu par transfert d´un agent infectieux, sans élément intermédiaire, d´un hôte infectieux (humain ou animal) à une porte d´entrée d´un hôte humain susceptible. La transmission indirecte nécessite l´intervention d´un élément intermédiaire, au niveau duquel l´agent se multiplie ou pas, qui peut être un véhicule contaminé ou un vecteur vivant qui peut assurer la transmission par transport mécanique ou biologique de l´agent avec dans ce dernier cas un cycle plus ou moins complexe de maturation avant que le vecteur devienne infectieux. Pour la transmission de personne à personne le paramètre essentiel est le taux de reproduction de base (R0) qui est le nombre de nouvelles infections générées par un sujet infectieux au sein d´une population complètement susceptible [11]. Dans une population ayant un certain niveau d´immunité on parlera de taux de reproduction net (R0) qui correspond à R0*f où f est la proportion de sujets susceptibles. Quand R est supérieur à 1 on a une épidémie ou une émergence ; quand il est inférieur à 1 la transmission est en voie de maîtrise et l´épidémie régresse. Le taux de reproduction est fonction du nombre de sujets infectés (I), du taux de contact (c) entre les sujets susceptibles et infectieux, du taux de transmission (t) pour un contact entre un sujet susceptible et un sujet infectieux et de la durée de l´infectiosité (d) du sujet infecté selon la formule suivante [11] :

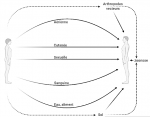
La rapidité de transmission d´un agent infectieux dépendra aussi de la durée du cycle de reproduction (durée moyenne entre la survenue de l´infection chez deux sujets distincts, le premier étant la source du second) [9]. La rapidité de transmission d´un agent infectieux dépendra aussi de la durée du cycle de reproduction (durée moyenne entre la survenue de l´infection chez deux sujets distincts, le premier étant la source du second) [9]. Le nombre de reproduction de base, R néant (R0), est défini comme le nombre moyen de cas secondaires d´une maladie infectieuse résultant d´un cas typique dans une population totalement sensible, et peut être estimé dans les populations si l´immunité préexistante peut être prise en compte dans le calcul. R0 détermine le seuil critique d´immunité de groupe et donc la couverture vaccinale requise pour parvenir à l´élimination d´une maladie infectieuse. À mesure que R0 augmente, une couverture vaccinale plus élevée est nécessaire pour obtenir l´immunité collective [12]. On peut en déduire le niveau critique d´immunité de groupe 1-f (f étant la fraction de la population susceptible), nécessaire à la régression de la transmission qui est égal à 1 - 1/ R0. S´il s´agit d´une immunité acquise par la vaccination, la couverture vaccinale critique nécessaire sera en tenant compte de l´efficacité vaccinale (EV) : 1 - 1/R0 * EV. Les programmes d´élimination de la rougeole peuvent bénéficier de l´application du concept épidémiologique du nombre de reproduction de base, R néant (R0). R0 est défini comme le nombre moyen de cas secondaires générés par un cas primaire dans une population complètement sensible [11]. Certains agents infectieux peuvent aussi passer de l´animal à l´homme (Figure 1). Ils font partie intégrante de la culture et de l´histoire de l´humanité. Des animaux sont des propagateurs de nombreuses maladies, notamment parmi les plus graves : la leptospirose, la choriomeningite lymphocytaire, le sodoku et la peste [13]. Des données sur le COVID-19 notamment indiquent qu´une transmission indirecte du virus causal s´est produite, résultant parfois d´une contamination virale d´objets courants, d´une aérosolisation virale dans un espace confiné ou d´une propagation de personnes infectées asymptomatiques [14].
Pour une infection donnée, l´hôte (animal ou humain) est infecté après exposition efficace à l´agent infectieux. Si l´infection est symptomatique l´intervalle de temps qui sépare l´infection du début des signes de la maladie est la période d´incubation. La période de maladie évolue vers la guérison, le passage à une maladie chronique ou la mort. La dynamique de l´infectiosité ne suit pas nécessairement le même cheminement : l´infectiosité peut débuter au même moment que les signes cliniques, avant ou après et se terminer avant la fin des symptômes ; dans certains cas l´infectiosité après une maladie aiguë peut persister de manière chronique et prolongée [15]. Stephen suggère que l´émergence d´une maladie infectieuse peut être considérée sur le plan opérationnel comme un processus en deux étapes notamment l´introduction de l´agent pathogène dans une nouvelle population hôte (infection humaine) suivie de l´établissement et la dissémination au sein de la nouvelle population hôte, c´est l´adoption [16]. Quelle que soit son origine, l´infection émerge lorsqu´elle atteint une nouvelle population. Les facteurs qui favorisent l´une de ces étapes ou les deux auront donc tendance à précipiter l´émergence de la maladie. La plupart des infections émergentes, et même des souches résistantes aux antibiotiques d´agents pathogènes bactériens courants, ont généralement leur origine dans un emplacement géographique et se propagent ensuite vers de nouveaux endroits [17]. La plupart des infections émergentes semblent être causées par des agents pathogènes déjà présents dans l´environnement, surgissant de l´obscurité ou bénéficiant d´un avantage sélectif en changeant les conditions et ont permis d´infecter de nouvelles populations hôtes [16,17]. Les facteurs qui influent sur l´émergence des maladies infectieuses peuvent être regroupé en 5, c´est notamment : des changements écologiques et le développement agricole [16,18]; des changements dans la démographie humaine et le comportement [19-21]; des voyages et commerces internationaux [20-24]; de la technologie et industrie[16,25,26] ; et une adaptation et changement microbiens [17,27-29].
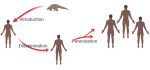
Ces 2 étapes d´évolution des maladies émergentes peuvent être subdivisées en 3 dans la population humaine, c´est notamment (Figure 2) : introduction de l´agent dans la population humaine ; sa diffusion ou dissémination et enfin sa pérennisation [9]. Quelques exemples des pandémies des maladies infectieuses émergentes. Comme l´ont démontré les épidémies de grippe, dans des circonstances appropriées, une nouvelle infection apparaissant pour la première fois n´importe où dans le monde pourrait traverser des continents entiers en quelques jours ou semaines. On parle alors de pandémie [9]. Une pandémie (du grec ancien πάv/pãn « tous », et δήμoς/dӗmos « peuple ») est une épidémie présente sur une large zone géographique internationale. Dans le sens courant, elle touche une partie particulièrement importante de la population mondiale. Les pandémies surviennent lors de déséquilibres majeurs liés à des modifications sociales et environnementales au cours de l´histoire (Tableau 1,Tableau 1(suite)) [30-34]. Les conséquences d´une pandémie non maîtrisée peuvent être très importantes [25,26,35-37]. Au XXIème siècle, la surveillance et le contrôle d´une pandémie reposent en premier lieu sur une coopération internationale [33,34].
Maladie à coronavirus 2019 (COVID-19): l´émergence récente du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) dans la province du Hubei en Chine fin 2019 démontre le potentiel épidémique des coronavirus. La propagation rapide de ce virus à travers le monde en seulement 2 mois met en évidence la transmissibilité de cette famille de virus et la morbidité et la mortalité importantes qu´ils peuvent provoquer [38]. Jusqu´à la fin de 2019, il y avait six coronavirus connus pour provoquer des maladies chez l´homme. Quatre parmi eux provoquent un rhume souvent banal [39]. Le premier cas de COVID-19 a été signalé à l´OMS par les autorités chinoises le 31 décembre 2019 à la suite d´un patient souffrant de pneumonie à Wuhan, dans la province du Hubei, en Chine. D´avantage de patients étaient soupçonnés de souffrir de la même maladie et, au 9 janvier, un nouveau coronavirus avait été détecté [40]. Le nouveau virus appartient à la famille des Coronaviridae et partage donc des caractéristiques communes à cette famille. Les coronavirus ont de grands (~ 30 kb) génomes d´ARN simple brin à sens positif. Les deux premiers tiers du génome codent pour 2 grandes polyprotéines (pp1a et pp1ab d´ORF1a et ORF1b) qui sont clivées protéolytiquement en protéines non structurelles (nsp1a -16) qui sont essentielles pour la production de nouveau matériel génétique viral. Le reste du génome code pour les protéines structurales et porte les gènes accessoires qui produisent des virions et modifient la réponse de l´hôte, respectivement [39].
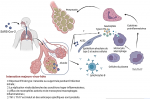
Le SRAS-CoV-2 se propage facilement dans la population humaine (Figure 3). L´absorption en aérosol de SARS-CoV-2 conduit à l´infection de cellules cibles exprimant ACE2 telles que les cellules alvéolaires de type 2 ou d´autres cellules cibles inconnues. Le virus peut atténuer les réponses antivirales de l´IFN entraînant une réplication virale non contrôlée. L´afflux de neutrophiles et de monocytes/macrophages entraîne une hyperproduction de cytokines pro-inflammatoires. L´immunopathologie pulmonaire peut être le résultat des « tempêtes de cytokines ». Des Th1/Th17 spécifiques peuvent être activés et contribuent à exacerber les réponses inflammatoires. Les cellules B / plasmocytes produisent des anticorps spécifiques au SARS-CoV-2 qui peuvent aider à neutraliser les virus. Les points d´interrogation indiquaient des événements encore spéculatifs ou inconnus. De nombreux agents de santé ont été infectés et de plus en plus de groupes de cas sont détectés chaque jour qui passe. Le taux de reproduction (R0) du virus est actuellement estimé entre 1,4 et 7,23 et la transmission interhumaine se fait par le biais de gouttelettes respiratoires [41-43].
Depuis les premiers stades de l´épidémie de COVID-19, le case fatality rate (CFR) a été d´environ 2% à 4%. C´est un CFR beaucoup plus faible que ceux observés pour le SRAS et le MERS, qui sont respectivement d´environ 10% et 35%. Cependant, de nombreuses personnes restent dans des conditions sévères dans les hôpitaux en raison de COVID-19, ce qui pourrait voir le CFR augmenter. Cela dit, le véritable fardeau de la maladie dans la population humaine est actuellement inconnu. Un rapport récent sur environ 44 000 patients chinois a montré que 81% ne développent que des symptômes bénins, tandis que 14% développent des symptômes graves et 5% tombent gravement malades [43]. Cette étude suggère que même parmi les personnes présentant des symptômes suffisamment graves pour être testées pour le SRAS-CoV-2, il peut toujours y avoir des symptômes légers, ce qui peut suggérer que de nombreuses autres personnes ont des symptômes suffisamment légers pour ne pas nécessiter de test. Cela ferait augmenter le nombre de cas réels et, par extension, le CFR plus bas. Les premières estimations suggéraient que le nombre réel de cas pouvait être jusqu´à 10 fois supérieur à ce qui avait été signalé [44]. À mesure que de nouveaux cas de COVID-19 se produisent, il est de plus en plus établi que les cas les plus graves et la mortalité sont associés à des problèmes de santé sous-jacents. Les comorbidités associées les plus courantes sont les maladies pulmonaires, le diabète et la vieillesse [42,45].
Les enfants ont souvent une maladie plus bénigne que les adultes et les décès sont extrêmement rares. La période d´incubation y est de 2 à 10 jours [46]. Les symptômes de COVID-19 semblent être moins graves chez les enfants que chez les adultes. C´est typiquement la clinique des infections respiratoires aiguës avec notamment : la toux (48,5%), l´érythème pharyngé (46,2%) et une fièvre d´au moins 37,5 degrés C (41,5%). Les autres symptômes étaient la diarrhée (8,8%), la fatigue (7,6%), la rhinorrhée (7,6%), les vomissements (6,4%) et les saturations en oxygène de moins de 92% (2,3%) [47]. La transmission verticale du COVID-19 n´a pas pu être exclue [48]. Peu de pays africains ont des capacités de diagnostic suffisantes et appropriées. En plus les pays africains ont des défis évidents pour y faire face. Les exigences minimales de prévention et de contrôle des infections (IPC) de l´OMS constituent le point de départ initial pour la construction d´éléments critiques supplémentaires des composants de base. La perturbation des chaînes d´approvisionnement et l´épuisement des stocks (tels que les fournitures et équipements médicaux) dans les environnements à ressources élevées et faibles ont catapulté le composant central IPC 8 (environnement bâti, matériaux et équipements pour IPC) aux gros titres quotidiens de la première page de la presse populaire et des médias sociaux. L´achat de panique et l´utilisation irrationnelle des équipements de protection individuelle (EPI) ont conduit à un approvisionnement insuffisant de respirateurs N95, et ces pénuries auront des conséquences potentiellement dévastatrices pour la gestion de la tuberculose multirésistante/extrêmement résistante aux médicaments dans les PRFM. Pour éviter les pénuries d´EPI essentiels pour la réponse au COVID-19, les gouvernements devraient donner des directives claires sur l´utilisation des EPI et agir maintenant pour garantir des approvisionnements et des stocks adéquats au cas où l´épidémie se propagerait à ces pays. La production régionale de fournitures médicales doit être envisagée pour tous les continents afin de réduire les risques de pénurie d´EPI à des moments cruciaux.
La transmission du SRAS-CoV2 se propage plus en hiver, par conséquent, l´hémisphère sud (Afrique noire et Amérique du Sud) sera affecté plus tard dans l´année. Les différences culturelles propres au climat (vivre plus à l´extérieur qu´à l´intérieur), l´effet de la lumière UV sur la survie du virus sur les surfaces, les différences immunologiques de la population (immunité innée), la préexposition aux antipaludiques ou les températures plus élevées pourraient tous y contribuer [49]. Alors que le nombre de cas et le nombre de morts de l´épidémie continuent d´augmenter, il devient impératif d´identifier les options thérapeutiques contre la COVID-19 [50-53]. L´OMS recommande pour les patients atteints de COVID-19 avec léger symptôme de recevoir un traitement symptomatique tel que du paracétamol contre la fièvre et la douleur, une nutrition adéquate et une réhydratation appropriée [53,54]. A ce jour, plusieurs études sont en court [55-58]. Des efforts ont été faits pour développer des vaccins contre les infections à coronavirus humain (CoV) comme le MERS et le SRAS au cours des dernières décennies. Cependant, à ce jour, aucun traitement ou vaccin antiviral autorisé n´existe pour le MERS et le SRAS. La plupart des efforts pour développer des vaccins et des médicaments contre le CoV ciblent la glycoprotéine de pointe ou la protéine S, le principal inducteur des anticorps neutralisants. Bien que quelques candidats aient démontré leur efficacité dans des études in vitro, peu ont progressé vers des essais randomisés sur des animaux ou sur des humains, leur utilisation peut donc être limitée pour lutter contre la COVID-19 [50,59,60]. Contre la COVID-19 plus de 400 essais cliniques sont répertoriés. Cependant, aucun médicament ou vaccin anti-SRAS-CoV-2 n´a été officiellement approuvé en raison de l´absence de preuves adéquates [61].
Les maladies infectieuses émergentes à travers l´histoire ont inclus certains des fléaux les plus redoutés. De nouvelles infections continuent d´émerger aujourd´hui, et des anciennes sévissent encore. L´année 2020 a commencé par une épidémie mondiale rapide du virus SARS-CoV-2, à l´origine de la maladie COVID-19. Le virus semble s´être transmis à l´homme lors d´un événement zoonotique. Il y a cependant encore de nombreuses questions à étudier concernant tous les aspects de la virologie et de l´épidémiologie du SRAS-CoV-2.
Les auteurs ne déclarent aucun conflit d´intérêts.
Tous les auteurs ont participé à la réalisation de l´étude, ont lu et approuvé la version finale du manuscrit. Tous les auteurs ont lu et approuvé la version finale du manuscrit.
Tableau 1: exemples récents d´infections émergentes et de facteurs prouvables dans leur émergence
Tableau 1(suite): exemples récents d´infections émergentes et de facteurs prouvables dans leur émergence
Figure 1: réservoirs et modes de transmission des maladies
Figure 2: les trois stades de l´émergence d´un agent nouveau au sein d´une population humaine : cas du COVID-19
Figure 3: réponses immunitaires proposées à l´hôte pendant l´infection par le SRAS-CoV-2
- Adhikari SP, Meng S, Wu Y-J, Mao Y-P, Ye R-X, Wang Q-Z et al. Epidemiology, causes, clinical manifestation and diagnosis, prevention and control of coronavirus disease (COVID-19) during the early outbreak period: a scoping review. Infect Dis Poverty. 2020;9(1):1-12. PubMed | Google Scholar
- Jones BA, Grace D, Kock R, Alonso S, Rushton J, Said MY et al. Zoonosis emergence linked to agricultural intensification and environmental change. Proc Natl Acad Sci. 2013;110(21):8399-8404. PubMed | Google Scholar
- Nicolle C. Destin des maladies infectieuses. 3ème Ed. Paris : Presse Universitaire de France. 1937.
- Proceedings and recommendations of the Expert Working Group on Emerging Infectious Disease Issues. Lac Tremblant Declaration December 1993. Can Commun Dis Rep. 1994;20 (Suppl 2): iii-21-iii-25. PubMed
- Aubry P. Reemergence of infectious diseases: example of viral diseases (from variola to Kaposi sarcoma). Arch Inst Pasteur Madagascar. 1996;63(1-2):48-52. PubMed | Google Scholar
- National Center for Biotechnology Information. Communicable Diseases, Emerging. 2001. PubMed
- Toma B, Thiry E. Qu´est-ce qu´une maladie émergente. Epidemiol Santé Anim. 2003;44(1):1-11. Google Scholar
- Morse SS. Factors in the emergence of infectious diseases. In: Price-Smith AT. (eds) Plagues and politics. London: Palgrave Macmillan; 2001. Google Scholar
- Desenclos J-C, De Valk H. Les maladies infectieuses émergentes: importance en santé publique, aspects épidémiologiques, déterminants et prévention. Med Mal Infect. 2005;35(2):49-61. Google Scholar
- Chin T. Control of Communicable Diseases in Man, Fourteenth Edition. J Public Health Pol. 1985;6 (1): 564-565. Google Scholar
- Anderson RM, Anderson B, May RM. Infectious diseases of humans: dynamics and control. Epidemiol Infect. 1992 Feb; 108(1): 211-212. Google Scholar
- Guerra FM, Bolotin S, Lim G, Heffernan J, Deeks SL, Li Y et al. The basic reproduction number (R 0) of measles: a systematic review. Lancet Infect Dis. 2017;17(12):e420-8. PubMed | Google Scholar
- Zarrouk O, Bouomrani S. Les anthropozoonoses. Pan African Medical Journal - Conference Proceedings. Jan 2018;7(7):3. Google Scholar
- Cai J, Sun W, Huang J, Gamber M, Wu J, He G. Indirect virus transmission in cluster of COVID-19 Cases, Wenzhou, China, 2020. Emerg Infect Dis. 2020;26(6): 1345-1347. PubMed | Google Scholar
- Fontenille D, Lagneau C, Lecollinet S, Lefait Robin R, Setbon M, Tirel B et al. La lutte antivectorielle en France. Marseille: IRD Éditions. 2013.
- Morse SS. Emerging viruses: defining the rules for viral traffic. Perspect Biol Med. 1991;34(3):387-409. PubMed | Google Scholar
- Soares S, Kristinsson KG, Musser JM, Tomasz A. Evidence for the introduction of a multiresistant clone of serotype 6B Streptococcus pneumoniae from Spain to Iceland in the late 1980s. J Infect Dis. 1993;168(1):158-163. PubMed | Google Scholar
- Johnson KM. Emerging viruses in context: an overview of viral hemorrhagic fevers. In: Morse SS. Emerging Viruses New York: Oxford University Press. 1993. Google Scholar
- Gubler DJ, Trent DW. Emergence of epidemic dengue. Infectious Agents and Disease. 1993;2(6):383-393. PubMed | Google Scholar
- LeDuc JW, Childs JE, Glass GE. The hantaviruses, etiologic agents of hemorrhagic fever with renal syndrome: a possible cause of hypertension and chronic renal disease in the United States. Annu Rev Public Health. 1992;13:79-98. PubMed | Google Scholar
- Wachsmuth IK, Evins GM, Fields PI, Olsvik �, Popovic T, Bopp CA et al. The molecular epidemiology of cholera in Latin America. J Infect Dis. 1993;167(3):621-626. PubMed | Google Scholar
- McNeill WH, McNeill W. Plagues and peoples. New York: Anchor Books/Doubleday. 1976.
- Gates B. Responding to COVID-19-A Once-in-a-Century Pandemic?. N Engl J Med. 2020;382(18):1677-1679. PubMed | Google Scholar
- MacIntyre CR. On a knife´s edge of a COVID-19 pandemic: is containment still possible? Public Health Res Pr. 2020;30(1):3012000. PubMed | Google Scholar
- Morse SS. Looking for a link. Nature. 1990;344(6264):297-297. PubMed | Google Scholar
- Control C for D, Prevention CDC. Update: multistate outbreak of Escherichia coli O157: H7 infections from hamburgers-western United States, 1992-1993. MMWR Morb Mortal Wkly Rep. 1993;42(14):258. PubMed | Google Scholar
- Davies J. Inactivation of antibiotics and the dissemination of resistance genes. Science. 1994;264(5157):375-382. PubMed | Google Scholar
- Domingo E, Holland JJ. Mutation rates and rapid evolution of RNA viruses. In: Morse SS (ed). Evolutionary Biology of Viruses New York: Raven Press. 1994. Google Scholar
- Woo PC, Lau SK, Huang Y, Yuen KY. Coronavirus diversity, phylogeny and interspecies jumping. Exp Biol Med. 2009;234(10):1117-1127. PubMed | Google Scholar
- de Pooter H. Les épidémies et les pandémies. In: Eudes M, Ryfman P, Szurek S (ed) Droit et pratique de l´action humanitaire. Besançon : LGDJ/Lextenso. 2019. Google Scholar
- Basileu C, Bounekkar A, Kabachi N, Lamure M. Vers un modèle de diffusion spatiale d´une pandémie. Lyon: Université de Lyon. 2010. Google Scholar
- Maljean-Dubois S, Mehdi R. La société internationale et les grandes pandémies. Paris : Pedone. 2007. Google Scholar
- Lai AY. Organizational collaborative capacity in fighting pandemic crises: a literature review from the public management perspective. Asia Pac J Public Health. 2012;24(1):7-20. PubMed | Google Scholar
- Shalala DE. Collaboration in the fight against infectious diseases. Emerg Infect Dis. 1998;4(3):354. PubMed | Google Scholar
- Broder S. The development of antiretroviral therapy and its impact on the HIV-1/AIDS pandemic. Antiviral Res. 2010;85(1):1-18. PubMed | Google Scholar
- Rodies KE. That great call: the pandemic of 1918. Nurs Health Care Perspect. 1998;19(5):204-205. PubMed | Google Scholar
- Molyneux DH, Savioli L, Engels D. Neglected tropical diseases: progress towards addressing the chronic pandemic. The Lancet. 2017;389(10066):312-325. PubMed | Google Scholar
- Weston S, Frieman MB. COVID-19: Knowns, Unknowns, and Questions. mSphere. 2020;5(2):1-5. PubMed | Google Scholar
- de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14(8): 523-534. PubMed | Google Scholar
- Gralinski LE, Menachery VD. Return of the Coronavirus: 2019-nCoV. Viruses. 2020;12(2):135. PubMed | Google Scholar
- Liu Y, Gayle AA, Wilder-Smith A, Rockl�v J. The reproductive number of COVID-19 is higher compared to SARS coronavirus. J Travel Med. 2020; 27(2): taaa021. PubMed | Google Scholar
- Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N Engl J Med. 2020; 382(13):1199-1207. PubMed | Google Scholar
- Guan W, Ni Z, Hu Y, Liang W, Ou C, He J et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708-1720. PubMed | Google Scholar
- Imai N, Dorigatti I, Cori A, Donnelly C, Riley S, Ferguson NM. Report 2: estimating the potential total number of novel Coronavirus cases in Wuhan City, China. Imperial College London. 2020;22-01.
- Novel CPERE. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China. Zhonghua Liu Xing Bing Xue Za Zhi Zhonghua Liuxingbingxue Zazhi. 2020;41(2):145. PubMed | Google Scholar
- Cai J, Xu J, Lin D, Xu L, Qu Z, Zhang Y et al. A Case Series of children with 2019 novel coronavirus infection: clinical and epidemiological features. Clin Infect Dis. Clin Infect Dis . 2020 Sep 12;71(6):1547-1551. PubMed | Google Scholar
- Ludvigsson JF. Systematic review of COVID-19 in children show milder cases and a better prognosis than adults. Acta Paediatr. 2020; 109(6):1088-1095. PubMed | Google Scholar
- Zaigham M, Andersson O. Maternal and perinatal outcomes with COVID-19: a systematic review of 108 pregnancies. Acta Obstet Gynecol Scand. 2020; 99(7):823-829. PubMed | Google Scholar
- French CT, Toesca IJ, Wu T-H, Teslaa T, Beaty SM, Wong W et al.. Dissection of the Burkholderia intracellular life cycle using a photothermal nanoblade. Proc Natl Acad Sci. 2011;108(29):12095-12100. Google Scholar
- Prompetchara E, Ketloy C, Palaga T. Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian Pac J Allergy Immunol. 2020; 38(1):1-9. PubMed | Google Scholar
- Dong L, Hu S, Gao J. Discovering drugs to treat coronavirus disease 2019 (COVID-19). Drug Discov Ther. 2020;14(1):58-60. PubMed | Google Scholar
- Li G, De Clercq E. Therapeutic options for the 2019 novel coronavirus (2019-nCoV). Nature Publishing Group. 2020 Mar;19(3):149-150. PubMed | Google Scholar
- Pradère B, Ploussard G, Catto JW, Rouprêt M, Misrai V. The Use of Nonsteroidal Anti-inflammatory Drugs in Urological Practice in the COVID-19 Era: Is “Safe Better than Sorry”? Eur Urol. 2020; 78(2):134-135. PubMed | Google Scholar
- Greenhalgh T, Koh GCH, Car J. COVID-19: a remote assessment in primary care. BMJ. 2020; 368(1):m1182. PubMed | Google Scholar
- Al-Tawfiq JA, Al-Homoud AH, Memish ZA. Remdesivir as a possible therapeutic option for the COVID-19. Travel Med Infect Dis. 2020; 34:101615. PubMed | Google Scholar
- Cameron MJ, Ran L, Xu L, Danesh A, Bermejo-Martin JF, Cameron CM, Muller MP et al. Interferon-mediated immunopathological events are associated with atypical innate and adaptive immune responses in patients with severe acute respiratory syndrome. J Virol. 2007;81(16): 8692-8706. PubMed | Google Scholar
- Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G et al. A trial of lopinavir-ritonavir in adults hospitalized with severe COVID-19. N Engl J Med. 2020; 382(19):1787-1799. PubMed | Google Scholar
- Gautret P, Lagier J-C, Parola P, Meddeb L, Mailhe M, Doudier B et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020; 56(1):105949. Google Scholar
- Dhama K, Sharun K, Tiwari R, Dadar M, Malik YS, Singh KP et al. COVID-19, an emerging coronavirus infection: advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics. Hum Vaccines Immunother. 2020;16(6):1232-1238. Google Scholar
- Ahmed SF, Quadeer AA, McKay MR. Preliminary identification of potential vaccine targets for the COVID-19 coronavirus (SARS-CoV-2) based on SARS-CoV immunological studies. Viruses. 2020;12(3):254. PubMed | Google Scholar
- Li H, Zhou Y, Zhang M, Wang H, Zhao Q, Liu J. Updated approaches against SARS-CoV-2. Antimicrob Agents Chemother. 2020; 64(6):e00483-20. PubMed | Google Scholar